学習・入試情報
2025年3月
pH曲線の謎
私が高校の時、化学を学んでいく中で、ここはまぁ、こういうモンだから。。で流した事が多くありました。
中でも、中和滴定曲線、がその最たるものでした。
「中和点付近では、劇的にpHが変化するので、pH曲線は鉛直になる」
先生がそうおっしゃった時、「なんで劇的に変化するんやねん」と思いました。
大人になって、教える側に回ると、それではいかんな、と思います。
ですので今日は、その理由を考えてみようと思います。

例えば0.1mol/LのHCLが1Lあります。
初めのpHは\( \text{pH} = - \log_{10} [H^+] \)ですので、pH=1となります。
これに、0.1mol/LのNaOHを入れていきます。
滴定曲線は\( \text{pH} = - \log_{10} [H^+] \)に沿います。NaOHを\( x \)L入れた時は\( 0.1x \)molの
\( OH^- \)がある訳ですから、元々0.1molあった\( H^+ \)は0.1\( x \)mol減り、\(0.1-0.1x \)molとなります。
また、\( x \)L入れると、溶液の体積は\( 1+x \) Lとなり、mol濃度は
\( \frac{0.1-0.1x}{1+x} \)mol/Lとなります。
ですので、\( \text{pH} = - \log_{10} \)\( \frac{0.1-0.1x}{1+x} \)となります。これをグラフにしてみましょう。
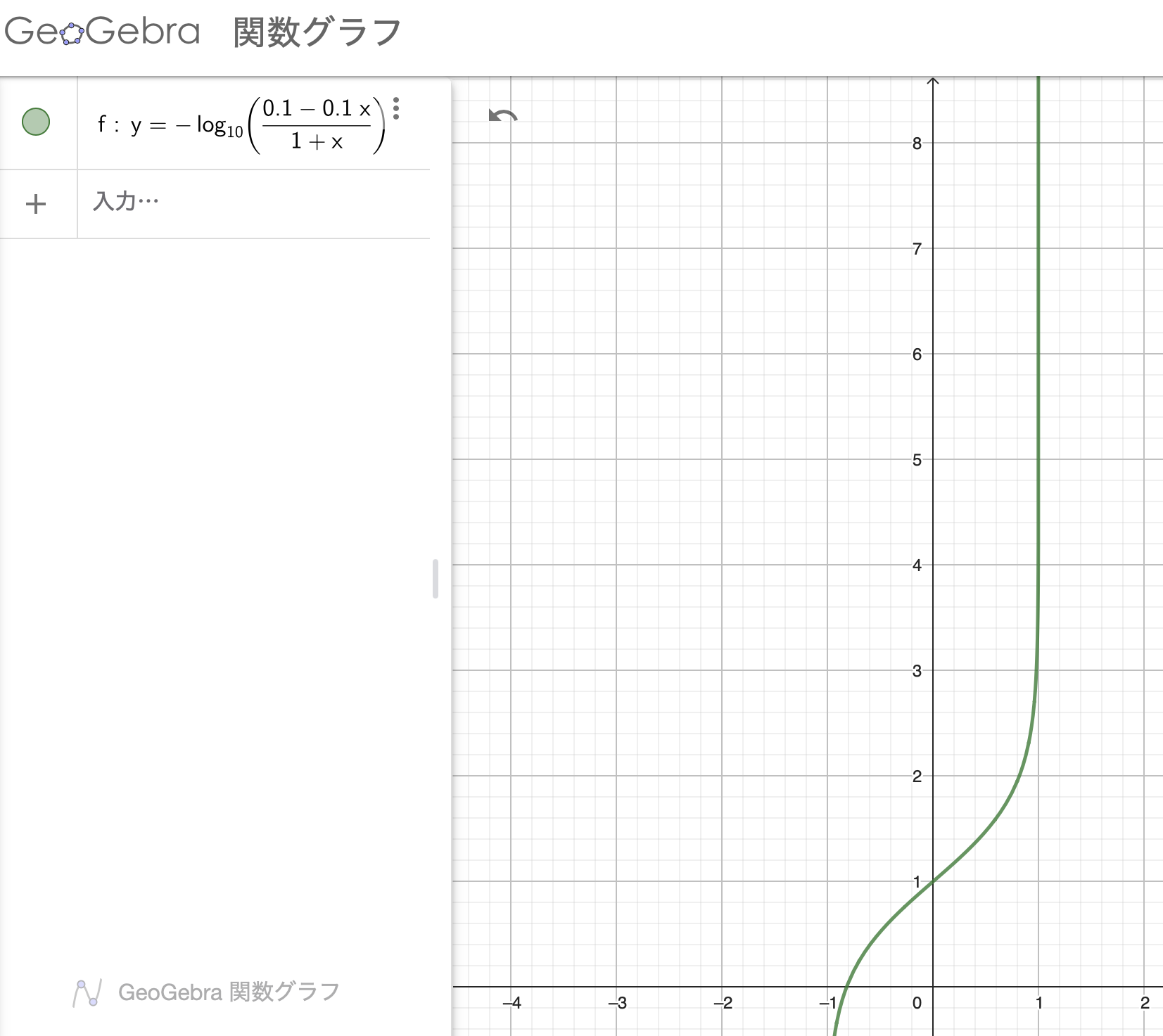
NaOHを1L入れたところで、急激に中和が進む、どころかpHが発散してしまっています。。
pHは14までしか無い訳で、これは現実に反する結果です。
実際は水のイオン積なるものが存在し、摂氏25度で
\( [H^+][OH^-] = 10^{-14} \)
と決まっており、
これは、水素イオン濃度と水酸化物イオン濃度の積は常に\( 10^{-14} \)に保たれる、と言うことを意味します。
つまり、HCl由来の\( H^+ \)が0になった際、
中和してこれはもう普通の水だから水のイオン積という別ルールが適応され、中性ということだから、
[H+]と[OH-]が同量あり、\( 10^{-7} \)ずつだよね、つまりpH=7と言う話になるのです。
そしてここからは、水のイオン積のルールに従います。
\( [H^+][OH^-] = 10^{-14} \)より、\( [H^+] \) = \(\frac{10^{-14}}{[OH^-]} \)ですよね。pH=-log10[H+]を変形していきます。
pH=-log10[H+]=-log10(10^-14/[OH-])=14+log10(OH-)となり、話はOHの濃度に転換しました。
ここで、xLのNaOHを滴下した際のOH-は0.1xmolですが、中和で0.1mol減ったため、中和後は0.1x-0.1molとなります。
mol濃度はこれを体積で割りますので、\( \frac{0.1x-0.1}{1+x} \)mol/Lです。
これを先ほどの式に当てはめて、\( \text{pH} = - \log_{10} \)\( \frac{0.1x-0.1}{1+x} \)
ですね。これがpH曲線となります。さあ、書いてみましょう。
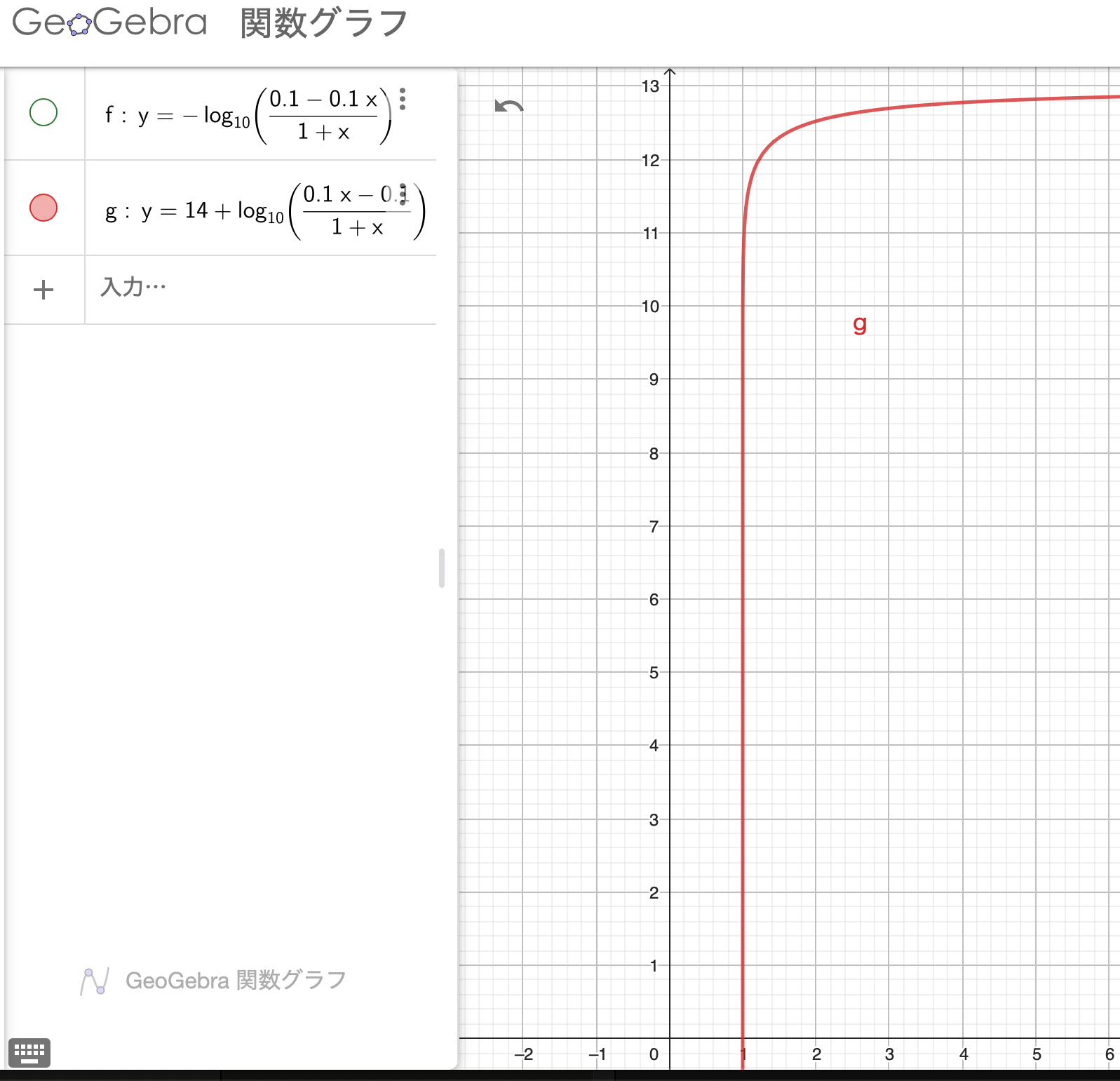
あれ、無限に注いでもpHが13にしかならない感じです。そうです。これは、pH=13のNaOHを注いでいるので当たり前です。
この2本の曲線をpH=7となる点で繋いでみましょう。
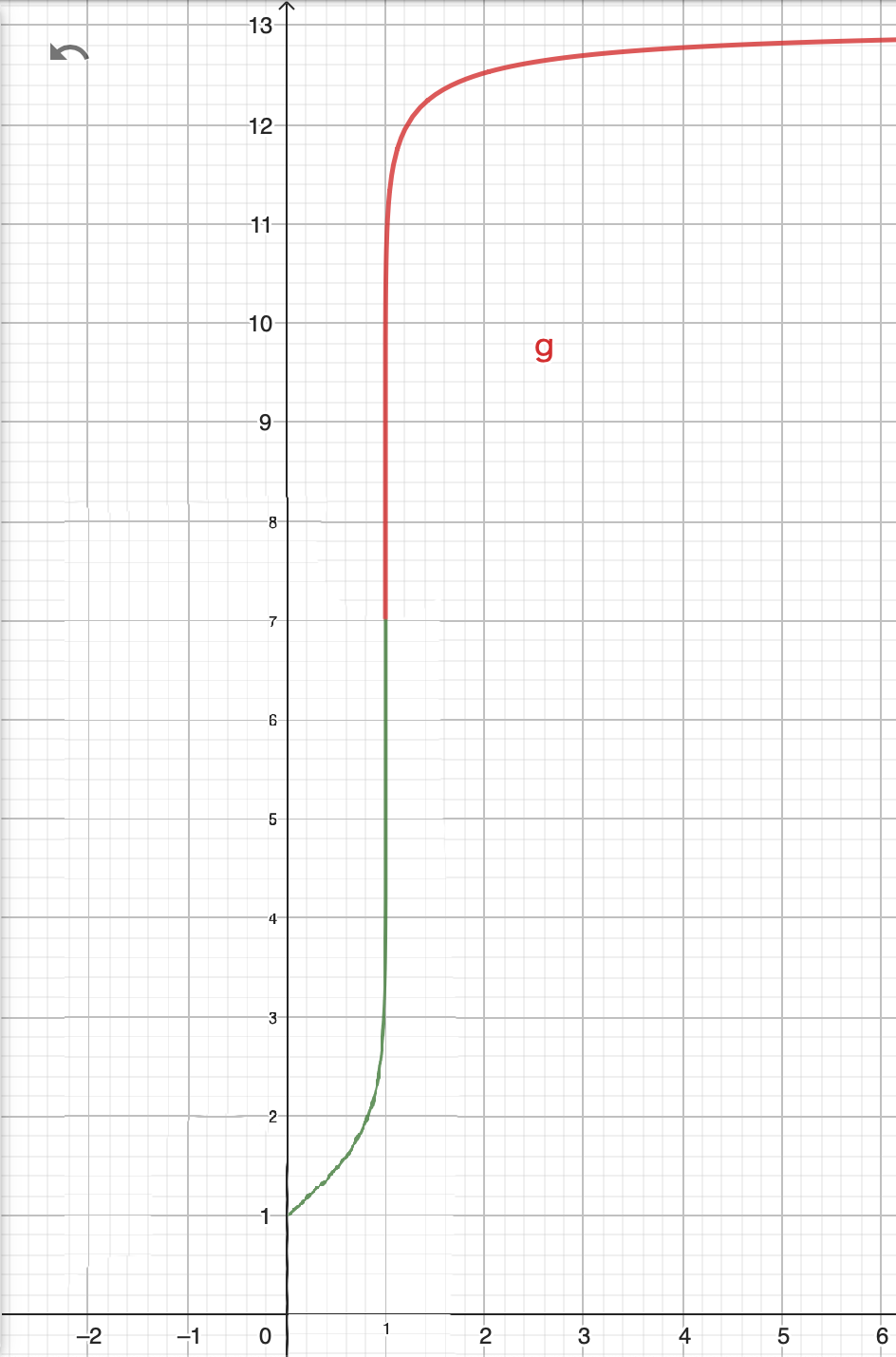
いかがでしょうか。見事なpHジャンプを描くことができました。
この様なpHジャンプが起きる理由としては、対数の性質が挙げられます。
\( y = \log_{10}x \)のグラフは0付近でマイナス無限大方向に急激に発散していきますが、
この急降下が縦方向に反転された形が2本組み合わさる事で、中和滴定曲線が形造られていたのです。
また、一見すると、中和点について点対称の様に見えますが、本当にそうでしょうか。
反転させて重ねてみると、明らかに点対称にはなりません。
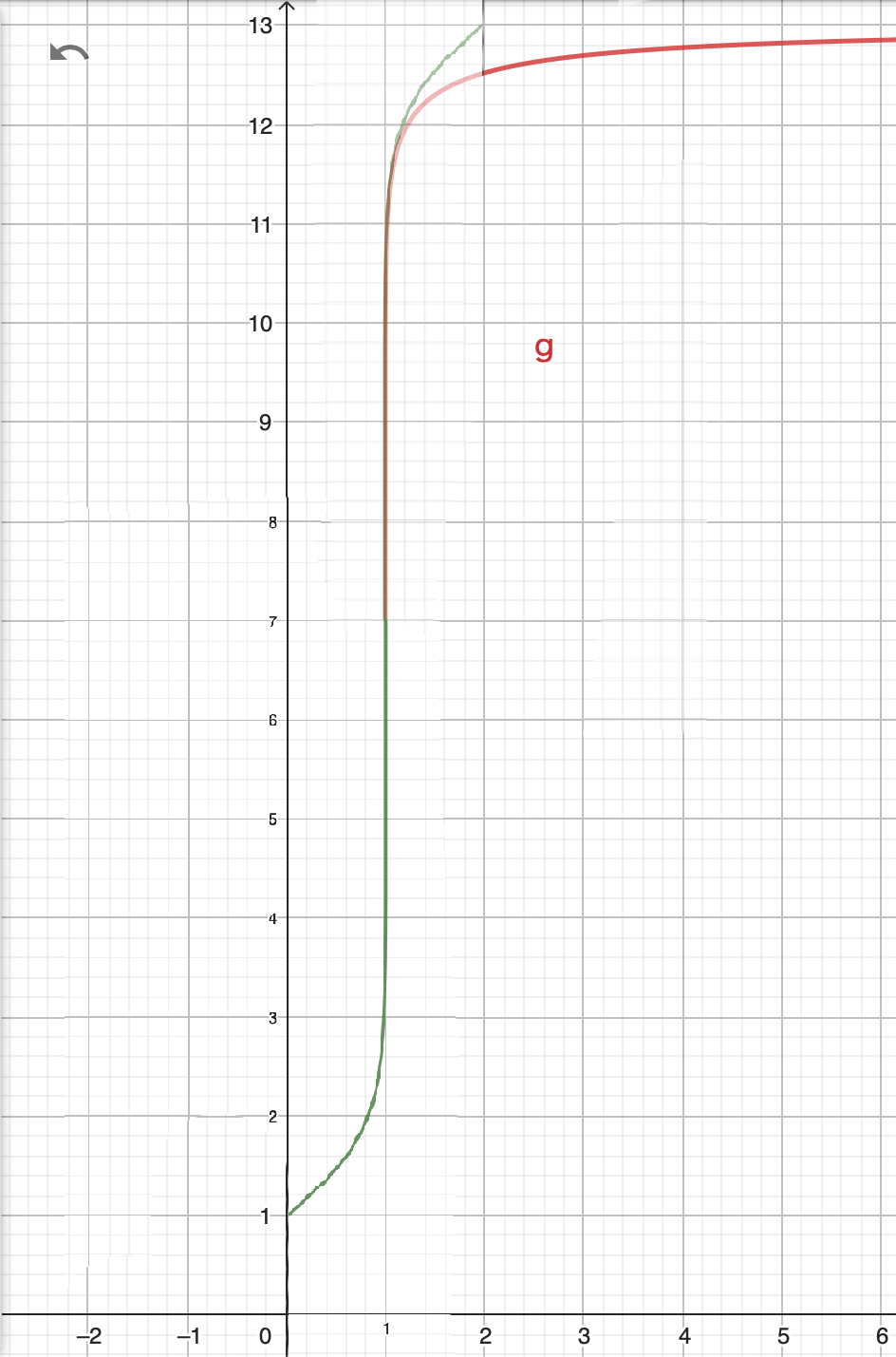
教科書を一歩深掘りすると、深遠な世界が広がっている様です。
